 发布时间:2020年03月05日15:41
中物联医药物流分会
发布时间:2020年03月05日15:41
中物联医药物流分会
 关注中物联
关注中物联
新冠肺炎发生至今,已两月有余,疫情快速覆盖全国各省份,并蔓延至海外。现已导致全国8万多病例确诊,千余人丧失生命。当白衣战士英勇奋战在抗疫最前线时,国内外政府部门、科研机构以及所有民众都在热切期盼疫苗的诞生。
据了解,目前已有20余家国内外科研机构与企业正在进行新冠病毒疫苗的研发,并且进度最快的已经进入到了动物试验阶段。据2月25日新闻报道,天津大学生命科学学院黄金海教授团队宣布已经成功研发出新型冠状病毒口服疫苗。但部分媒体将此消息命为“疫苗已经研制成功”的标题,引起大众认为“该疫苗已经上市并广泛用于人群接种”的误解。
对此,我们为如此快速的研发进展感到欣喜之余,也应该认识到一支疫苗从无到有是需要很长时间的客观事实。疫苗从研发到上市需要反复的研究、修改、检测、审批等一系列环节,经过进一步的验证其安全性、有效性等各方面效果,才可以上市流通。

了解疫苗诞生,首先要知道你所想了解的“疫苗”究竟是什么?疫苗是指为预防、控制疾病的发生、流行,用于人体免疫接种的预防性生物制品。它包括免疫规划疫苗和非免疫规划疫苗,也就是我们之前所说的一类疫苗和二类疫苗。


我们每个人从小到大都或多或少接种过疫苗,可是,大家从来不知道那小小的一针剂到底经历了多少岁月的“打磨”。事实上,疫苗同新药品一样从研发到接种都要经过一个漫长的过程,需要通过很多环节,且环环相扣,缺一不可。

01
研发
疫苗作为长期资产,进入壁垒很高,需要耗费大量的人力与财力。所谓万事开头难,疫苗的前期研发阶段最为持久,主要包括临床前研究、申报临床、临床试验机构申请、注册临床试验众多环节。其中,临床试验是疫苗上市的关键。根据2019年颁布的《疫苗管理法》规定,疫苗必须要经过临床试验验证后才允许注册上市。
来源:《财经》视觉中心
临床前研究
申报临床
在申请预防用疫苗临床试验时,需要向国家药品监督管理部门报送药学、药理毒理、临床等不同专业的研究资料。经过生物制品药学、药理毒理学、临床等相关领域专家按照国家《药品注册管理办法》及疫苗相关技术评价要求对全套研究资料进行技术审评后,就会对符合要求的获发疫苗临床试验批件。其中,质量控制及安全有效性未达到临床试验要求的,则需企业完善并补充各种试验或申报资料。
临床试验机构申请
在获得申报临床批件后,企业就要根据国家《一次性疫苗临床试验机构资格认定管理规定》选择出符合要求的临床研究现场和临床研究者了,随后即可向监管部门提出疫苗一次性临床试验机构的认定申请。需要注意的是,临床试验所用样品必须在符合国家《药品生产质量管理规范》(GMP)要求的厂房生产,企业自检结果和中检院检定结果均需合格。
注册临床试验
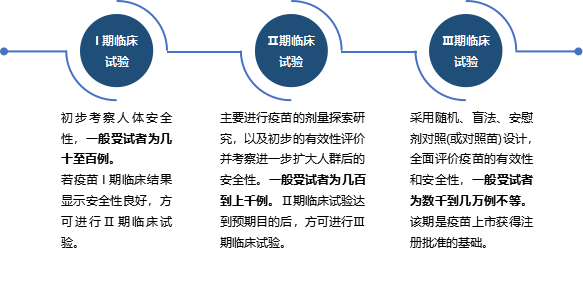
新型疫苗的临床试验一般分为I期、Ⅱ期、Ⅲ期,三个研究阶段,其中,Ⅲ期临床试验是疫苗上市生产的关键。若Ⅲ期临床试验获得预期临床保护效果且安全性良好,企业便可将临床数据资料递交国家药品监督管理部门申报生产。然而,国家对临床试验都设有严密的安全性监测以及严格的终止标准,此环节通常耗时3-8年,也有长达10年以上的,甚至会出现达不到预设目的或预期要求而在临床期间就被叫停、被终止的可能性。
02
注册上市
我国对于疫苗的审批和监管是相当严格的,企业在完成疫苗临床试验后,相关部门将对其数据、资料、生产现场、生产全过程以及产品等进行审评、检查、抽样、检验等工作,对于合格的企业,相关部门会批准该疫苗的上市注册申请,疫苗就可以上市了。
提交研究数据+资料
完成疫苗临床试验后,企业需要按照《药品注册管理办法》规定提交申报生产的研究数据及资料,经生物制品药学、药理毒理学、临床及生物统计等相关领域专家审评,认定疫苗安全、有效、质量可控,并经临床数据核查后,国家药品监督管理部门便给企业发生产现场检查通知。
生产现场检验
企业收到生产现场检查通知后,要在180天内准备好符合GMP要求的生产车间。经检查组对三批生产车间、三批疫苗一致性系统进行从投料至形成最终产品的生产过程各个环节的系统性动态验证,并对关键中间品进行抽样、检定后,将产品现场封样,送往中检院检定。确定疫苗安全、有效、工艺真实、质量可控,即给企业核发生产批件,附带质量标准、生产工艺及使用的说明书/标签。
03
生产
04
流通
采购
《疫苗管理法》提出国家免疫规划疫苗由国务院卫生健康主管部门会同国务院财政部门等组织集中招标或者统一谈判,形成并公布中标价格或者成交价格,各省、自治区、直辖市实行统一采购。国家免疫规划疫苗以外的其他免疫规划疫苗、非免疫规划疫苗由各省、自治区、直辖市通过省级公共资源交易平台组织采购。
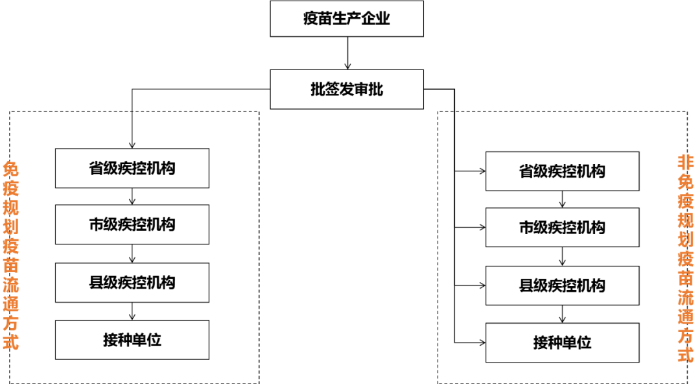
自山东疫苗案发生后,国家取消了疫苗行业的中间流通环节,规定生产企业直供终端疾控中心,也就是被大家称之为疫苗“一票制”改革,即疫苗从出厂到接种只需要一张发票。“一票制”最大限度的压缩了中间流通环节,挤压流通过程多余水分,防止虚开发票的现象,一定意义上提高了流通效率,确保疫苗在流通过程的全程可追溯,保证疫苗质量。疫苗“一票制”施行以来效果远远超出预期。
运输
如果说疫苗研发是迈向成功的第一步,那么疫苗的运输、配送则是保证疫苗成功接种的临门一脚。疫苗作为温度敏感的特殊药品,在储存、运输、配送等环节有着严格的冷藏保温要求,温度过高或过低都可能导致疫苗失效。
05
接种
你以为疫苗接种就完成了么?事实上,接种阶段有一部分临床研究称之为IV期临床研究,是指新药上市后应用研究阶段,通常观察人数为数千至数万人,主要目的是为了考察疫苗在大面积人群中使用的安全性与有效性。

以上,疫苗从研发到投入市场接种等一系列繁琐的流程完毕。基本经历的五大步骤我们可能比较容易去理解,但是知易行难,疫苗从研发至接种整个流程中,涉及众多部门交叉工作,仅仅是研发过程,就要经历海量的研究、无数次的实验、检测等等,疫苗研发就是一项综合性、长周期、高成本的研究工作,急不得也慢不得,研发之路道阻且难,但值得我们期待。
据了解,一般的疫苗从研发至上市需要8-20年的时长。目前,国家科技攻关团队已积极并行推进多个技术进行疫苗研究,全力以赴以便能早日实现疫苗研发成功。我们相信中国速度,亦相信中国质量。疫苗上市的时间一定不会太晚,但也请为科研人员预留一些时间吧。新冠肺炎疫情已进入关键时期,我们耐心等待疫苗问世的同时,持续做好个人防护工作,不给医护人员负担,不给祖国添乱。
 责任编辑:中物联医药物流分会
责任编辑:中物联医药物流分会
